Une équipe de recherche de « Synapsy » a montré que la sévérité des symptômes cliniques de la schizophrénie est fortement liée aux biomarqueurs sanguins liés à la dérégulation des mitochondries neuronales.
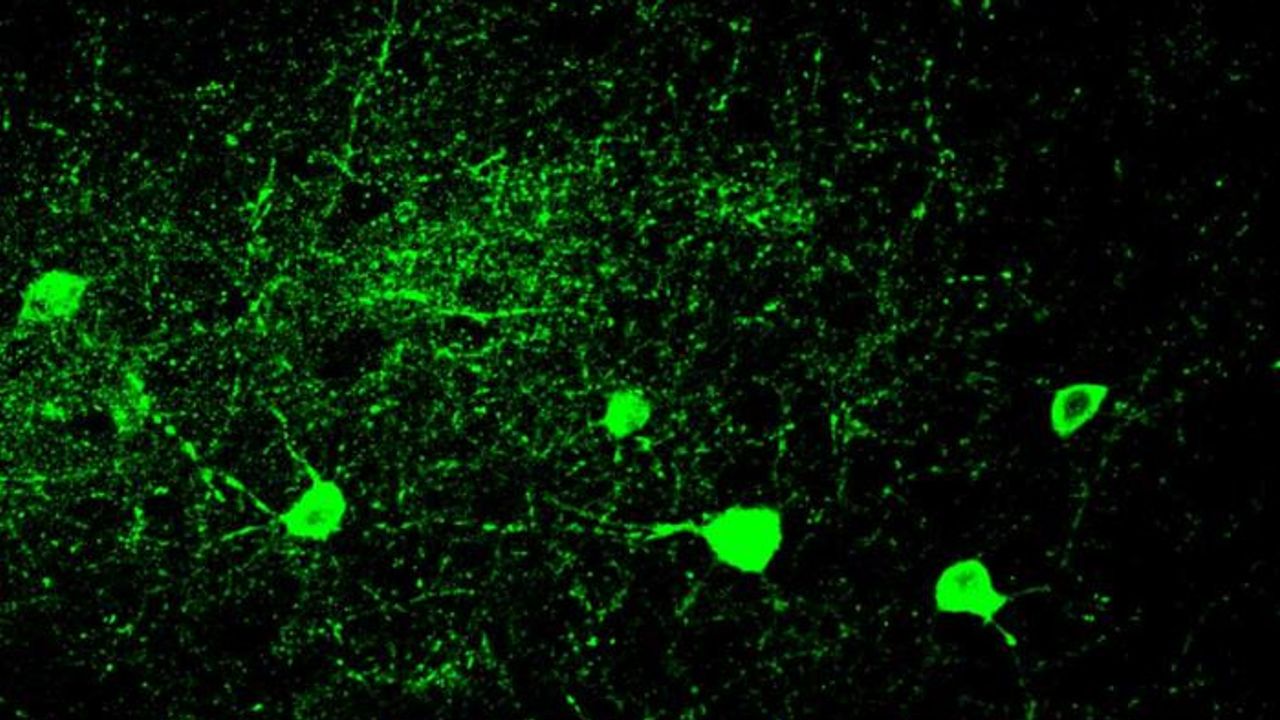
Neurones à parvalbumine de souris. Crédit : @UNIL/CHUV Inès Khadimallah
Une étude menée au Centre de neurosciences psychiatriques de l’Université de Lausanne (UNIL) et du Centre hospitalier universitaire vaudois (CHUV), soutenue par le Pôle de recherche national Synapsy (Synapsy), a montré, grâce à un modèle animal, que le mécanisme cellulaire de recyclage des mitochondries est déficient en neurones à parvalbumine.
Les mitochondries sont généralement capables d’éliminer leurs parties endommagées en se scindant, en utilisant un mécanisme appelé mitophagie. Ce processus implique une série de molécules dont la production est contrôlée par miR137, un microARN qui joue un rôle clé dans leur régulation. Inès Khadimallah, en collaboration avec ses collègues, a réussi à démontrer que le niveau de miR-137 était très élevé dans le modèle, tout comme le stress oxydatif. En parallèle, la molécule COX6A2, élément de la respiration cellulaire exprimé spécifiquement par les neurones à parvalbumine, est diminuée. « En d’autres termes, les mitochondries des neurones à parvalbumine sont dysfonctionnelles suite à l’augmentation du stress oxydatif, et cela peut être démontré en analysant les niveaux de miR-137 et COX6A2 dans le sang ».
Dans leurs tentatives d’intervenir directement sur les radicaux libres produits par les mitochondries, les neuroscientifiques ont montré, dans le modèle animal, que les altérations de ces deux molécules, miR137 et COX6A2, peuvent être complètement corrigées par un composé antioxydant qui cible spécifiquement les mitochondries, appelé MitoQ.

